Mutations de la protéine S du SRAS-CoV-2
Les mutations génomiques jouent un rôle clé dans la propagation du SARS-COV-2 et du virus en général. Elles peuvent faciliter l'infection et constituer un défi supplémentaire pour la détection par la cellule hôte. Elles constituent donc des cibles de recherche importantes, notamment dans le contexte de la conception de vaccins et de médicaments.
- Type sauvage, protéine de pointe Cov-2 pleine longueur.
- Pour le développement de tests.
- Livraison en 3 à 4 jours.
- Incl. N501Y, E484K Mutation.
- Source: HEK-293 Cells
- Pour les tests ELISA et Ligand Binding Assay.
- Livraison en 2 à 3 jours.
- Incl. N501Y Mutation.
- Source: HEK-293 Cells.
- Pour les tests ELISA et Ligand Binding Assay.
- Livraison en 2 à 3 jours.
- T19R, L452R, T478K, D614G, P681R, D950N
- Source: HEK-293 Cells
- Rho-1D4 Tag.
- Livraison en 3 à 4 jours.
- Inkl. N501Y, Q498R, H655Y, N679K et P681H.
- Source : Cellules HEK-293
- Pour les tests ELISA et Ligand Binding Assay.
- Huite Livraison

Mutations dans la lignée B.1.1.7 et B.1.351 / 501Y.V2
La mutation N501Y est une mutation non synonyme au sein du domaine de liaison au récepteur de la protéine S (RBD) partagée par les deux lignées B.1.1.7 et 501Y.V2 du SRAS-CoV-2 identifiées pour la première fois dans le sud-est de l'Angleterre et en Afrique du Sud respectivement. Il s'agit de l'un des principaux résidus de contact au sein du RBD et a été identifié comme ayant une affinité de liaison croissante avec l'ACE2 humain et murin. Il n'existe actuellement aucune preuve suggérant que les mutations de ces variantes ont un impact sur la gravité de la maladie ou l'efficacité du vaccin. Il a cependant été spéculé qu'elles conduisent à des concentrations plus élevées dans les voies aériennes supérieures et augmentent ainsi le taux de transmission du virus d'environ 50%.
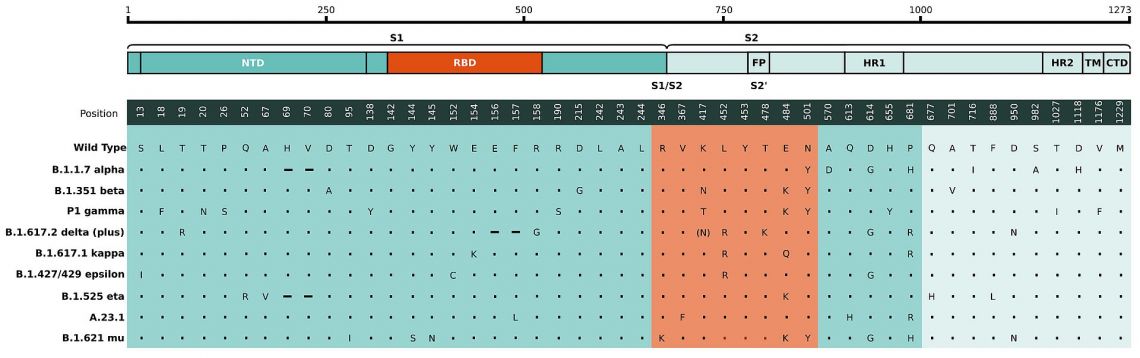
Fig. 1: Modifications des acides aminés dans la région du pic des génomes cartographiée à la structure des séquences des protéines du pic. Comparaison des mutations du pic viral identifiées dans B.1.351 / 501Y.V2 (SA), B.1.1.7 (UK) A.23.1 (UG) et P.1 (BR). La région RBD est mise en évidence (orange).
La mutation E484K, présente dans les nouvelles lignées 501Y.S2 et B.1.1.28 d'Afrique du Sud et du Brésil respectivement, affecte un résidu au sein de la RBD qui s'est avéré important pour la liaison de nombreux anticorps neutralisants. En conséquence, cette mutation affecte la reconnaissance des anticorps et permet l'échappement immunitaire du CoV-2 du SRAS. Il a été démontré que le virus porteur de cette mutation échappe à la reconnaissance des anticorps dans les sérums des personnes convalescentes et peut donc altérer l'efficacité des vaccins. 7,8,9
D614G Mutation
La mutation D614G (Asp614Gly) est devenue dominante dans la région européenne, ce qui indique un avantage de forme par rapport à la souche originale de Wuhan qui permet une propagation plus rapide. Plusieurs études récentes indiquent que la mutation D614G diminue l'interaction entre les unités S1 et S2, facilitant l'excrétion de S1 à partir de S2 lié à la membrane virale. Cela conduit à une augmentation de la protéine S totale incorporée dans le virion et donc à des particules virales plus stables.1,2,3 Nous proposons également la protéine D614G mutante du SRAS-CoV-2 S sous une forme trimérique, ce qui permet aux chercheurs d'effectuer des études virologiques et immunologiques plus détaillées sur l'effet biologique de la mutation.
- (4)
- (4)
- (4)
Autres mutations de la protéine de pointe
Plusieurs autres mutations ont été découvertes. Les mutations V367F (Val367Phe), N354D (Asn354Asp), W436R (Trp436Arg) ou V483A (Val483Ala) de la protéine S1 se lient avec une plus grande affinité à l'ECA2.4,5 Les mutations V483A et G476S (Gly476Ser) ont été précédemment rapportées comme étant liées à l'affinité de liaison aux récepteurs humains dans la recherche MERS et SARS-CoV.10 R408I (Arg408Ile) d'autre part réduisent potentiellement l'affinité de liaison ACE2.6
- (1)
- (3)
- (1)
- (3)
- (1)
- (3)
- (4)
Protein Structure of some Mutation S-Proteins
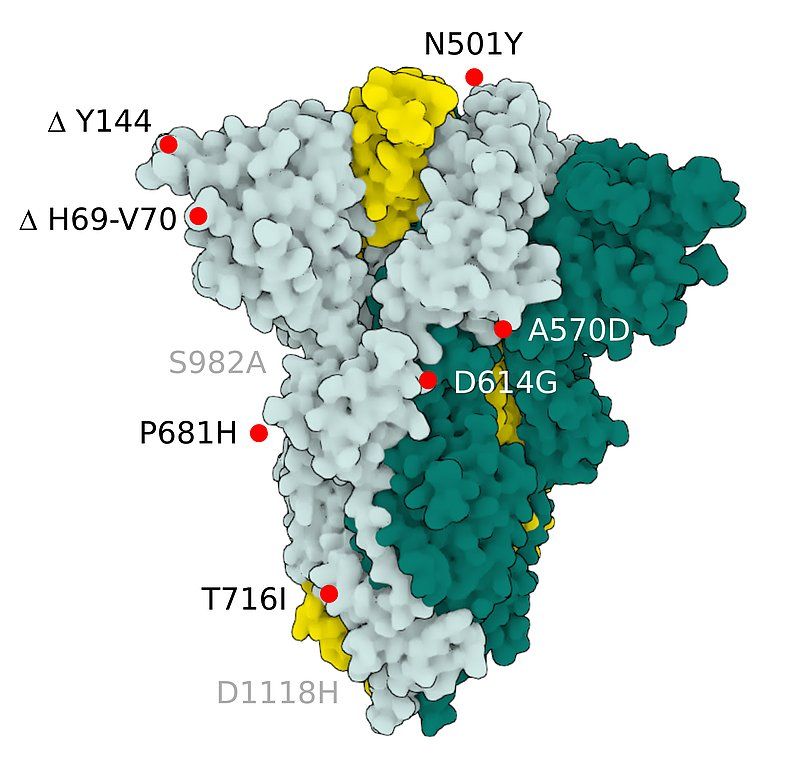
Fig.2 SARS-CoV-2 S Protein B.1.1.7 (alpha)
Fig.3 SARS-CoV-2 S Protein B.1.351 (beta)
Fig.4 SARS-CoV-2 S Protein B.1.617.2 (delta)
Fig.5 SARS-CoV-2 S Protein P.1 (gamma)
Références
- (1) Jie Hu et al. The D614G mutation of SARS-CoV-2 spike protein enhances viral infectivity and decreases neutralization sensitivity to individual convalescent sera. bioRxviv (2020).
- (2) Korber B. et al.Spike mutation pipeline reveals the emergence of a more transmissible form of SARS-CoV-2. bioRxviv (2020). doi.org/10.1101/2020.04.29.069054.
- (3) Lizhou Zhang et al. The D614G mutation in the SARS-CoV-2 spike protein reduces S1 shedding and increases infectivity. bioRxviv (2020). doi.org/10.1101/2020.06.12.148726.
- (4) Junxian Ou et al. Emergence of RBD mutations in circulating SARS-CoV-2 strains enhancing the structural stability and human ACE2 receptor affinity of the spike protein. bioRxiv (2020). doi:10.1101/2020.03.15.991844v4
- (5) Saha, P. et al.Mutations in Spike Protein of SARS-CoV-2 Modulate Receptor Binding, Membrane Fusion and Immunogenicity: An Insight into Viral Tropism and Pathogenesis of COVID-19. chemRxiv (2020). doi:10.26434/chemrxiv.12320567.v1
- (6) Jian Shang, Yushun Wan, Chuming Luo, Gang Ye, Qibin Geng, Ashley Auerbach, Fang Li. Cell entry mechanisms of SARS-CoV-2. Proceedings of the National Academy of Sciences May 2020, 117 (21) 11727-11734; DOI: 10.1073/pnas.2003138117
- (7) Allison J. Greaney, Andrea N. Loes, Katharine H.D. Crawford, Tyler N. Starr, Keara D. Malone, Helen Y. Chu, Jesse D. Bloom, bioRxiv 2020.12.31.425021; doi: https://doi.org/10.1101/2020.12.31.425021
- (8) Nicholas G. Davies, Rosanna C. Barnard, Christopher I. Jarvis, Adam J. Kucharski, James Munday, Carl A. B. Pearson, Timothy W. Russell, Damien C. Tully, Sam Abbott, Amy Gimma, William Waites, Kerry LM Wong, Kevin van Zandvoort, CMMID COVID-19 Working Group, Rosalind M. Eggo, Sebastian Funk, Mark Jit, Katherine E. Atkins, W. John Edmunds. Estimated transmissibility and severity of novel SARS-CoV-2 Variant of Concern 202012/01 in England. medRxiv 2020.12.24.20248822; doi: https://doi.org/10.1101/2020.12.24.20248822
- (9) Houriiyah Tegally, Eduan Wilkinson, Marta Giovanetti, et al. Emergence and rapid spread of a new severe acute respiratory syndrome-related coronavirus 2 (SARS-CoV-2) lineage with multiple spike mutations in South Africa. medRxiv 2020.12.21.20248640; doi: https://doi.org/10.1101/2020.12.21.20248640
- (10) Kim JS, Jang JH, Kim JM, Chung YS, Yoo CK, Han MG. Genome-Wide Identification and Characterization of Point Mutations in the SARS-CoV-2 Genome. Osong Public Health Res Perspect. 2020;11(3):101-111. doi:10.24171/j.phrp.2020.11.3.05
- (11) Pengfei Wang, Lihong Liu, Sho Iketani, Yang Luo et al. Increased Resistance of SARS-CoV-2 Variants B.1.351 and B.1.1.7 to Antibody Neutralization. bioRxiv preprint posted January 26, 2021. ; https://doi.org/10.1101/2021.01.25.428137doi.




