La cytométrie de flux (analyse FACS) est une méthode qui permet d'évaluer les protéines de la membrane cellulaire, les protéines intracellulaires ainsi que les peptides et l'ADN. Le principe sous-jacent de l'analyse FACS est une réaction antigène-anticorps, les anticorps étant marqués par fluorescence. La quantification de la cytométrie de flux est réalisée en intercalant des marqueurs de couleur (sans l'anticorps).
Qu'est-ce que l'analyse FACS ?
L'acronyme FACS" (ou analyse FACS) signifie fluorescence activated cell sorting en anglais (tri cellulaire induit par fluorescence). Le terme FACS est à l'origine un nom de marque de Becton Dickinson (BD) qui a gagné en popularité et est aujourd'hui le nom commun employé pour désigner la cytométrie de flux. Cependant, l'équipement et les machines nécessaires à la cytométrie de flux continuent d'être proposés par plusieurs fabricants sous des noms différents.
La base d'une analyse FACS repose sur une suspension (colorée et) marquée de cellules individuelles soumise à un faisceau laser focalisé. Des forces capillaires poussent les cellules à franchir la cellule de flux, où les marqueurs sont stimulés par le rayonnement du laser. La lumière fluorescente émise par les fluorophores (combinés aux anticorps) et la lumière diffusée sont détectées séparément.
Anticorps FACS populaires
Produit
Clonalité
Reactivity
N° du produit
Validations
Quantité
Fiche technique
Clonalité
Polyclonal
Reactivity
Cow, Human, Mouse, Pig, Rabbit, Rat
N° du produit
ABIN724340
Quantité
100 μL
Clonalité
Polyclonal
Reactivity
Coral
N° du produit
ABIN361314
Quantité
100 μg
Clonalité
Polyclonal
Reactivity
Human, Mouse, Rat
N° du produit
ABIN1387847
Quantité
100 μL
Clonalité
Polyclonal
Reactivity
Human, Monkey, Mouse, Pig, Rat, Sheep
N° du produit
ABIN724205
Quantité
100 μL
Clonalité
Polyclonal
Reactivity
Dog, Human, Monkey, Mouse, Rat
N° du produit
ABIN1440014
Quantité
600 μg
Clonalité
Polyclonal
Reactivity
Human
N° du produit
ABIN2855074
Quantité
100 μL
Clonalité
Polyclonal
Reactivity
Human
N° du produit
ABIN2857032
Quantité
100 μL
Clonalité
Polyclonal
Reactivity
Chicken, Human, Mouse, Pig, Rat
N° du produit
ABIN671376
Quantité
100 μL
Clonalité
Polyclonal
Reactivity
Human, Mouse, Pig
N° du produit
ABIN687337
Quantité
100 μL
Clonalité
Polyclonal
Reactivity
Human, Mouse, Rat
N° du produit
ABIN685477
Quantité
100 μL
Diffusion lumineuse
Les cellules diffusent une fraction lumineuse qui est ensuite détectée par des photomultiplicateurs (détecteurs de lumière). La quantité de lumière mesurée correspond à la taille des cellules et à leur complexité. Les , par exemple, reflètent davantage de lumière que les lymphocytes B ou T à surface lisse en raison de la texture rugueuse de leur surface et de la quantité plus élevée de vésicules présentes dans la cellule. L'analyse de la diffraction de la lumière selon un angle plat est appelée prodiffusion (FSC, forward scatter), laquelle dépend du volume de la cellule. L'analyse de la diffraction de la lumière dans un angle droit est appelée diffusion latérale (SSC, sidewards scatter). Elle dépend de la granularité, de la taille des cellules, de la structure de leur noyau, et de la quantité de vésicules contenues dans les cellules. Par exemple, il est possible de distinguer des globules rien qu'en observant ces deux analyses (Fig. 1).
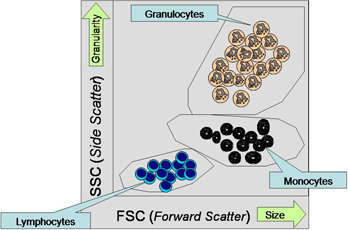
Fig. 1. Caractérisation de cellules non colorées à l'aide d'une diffusion de lumière (graphique à points) En haut à droite : grosses cellules En haut : cellules granulaires Les grosses cellulaires granulaires (par ex., les ) sont visibles en haut à droite tandis que les petits globules blancs, qui sont lisses, sont visibles en bas à gauche.
Analyses de la fluorescence (analyse par cytométrie de flux)
Des couleurs fluorescentes peuvent être mesurées de manière simultanée à l'aide de la lumière diffusée lors de la cytométrie de flux. Seules quelques cellules produisent une lumière fluorescente de manière endogène. En utilisant, par exemple, les substances colorimétriques DAPI et iodure de propidium qui s'intercalent dans l'ADN d'une cellule (entre les paires de base), il est possible de mesurer la quantité d'ADN d'une cellule en déterminant la brillance de cette cellule. Des anticorps marqués par fluorescence peuvent également être utilisés. En général, les anticorps utilisés ciblent les protéines de surface (par ex., les ; CD = cluster de différenciation). La densité d'informations peut être augmentée en utilisant des filtres et une lumière laser de couleurs différentes. Si les longueurs d'ondes de la lumière transmise par fluorescence depuis les fluorophores peut être discernée, alors il est possible d'utiliser plusieurs marqueurs de couleurs (coloration multiple).
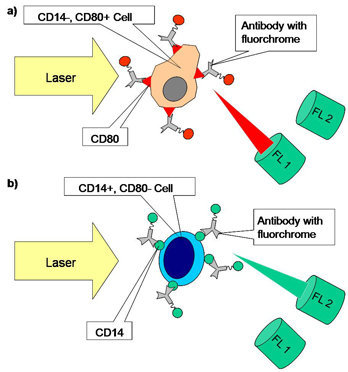
Fig. 2. Schéma des cellules colorées dans une analyse FACS. La première image représente une cellule positive et une cellule négative. Le fluorochrome combiné à l'anticorps est stimulé par la lumière du laser et émet une lumière fluorescente d'une certaine longueur d'onde (en rouge). La lumière est mesurée au niveau du canal fluorescent 1. La deuxième image illustre une cellule CD80 négative et une cellule CD14 positive. Le canal deux analyse la lumière du fluorochrome d'une autre longueur d'onde (en vert).
Grâce au logiciel du fabricant de l'équipement, les résultats finaux des analyses réalisées sont présentées dans un graphique. Le type de graphique peut être choisi par l'utilisateur. Généralement, les graphiques à point et les histogrammes sont les plus utilisés. Les colorations mentionnées plus haut pourraient donner ceci :
GRAPHIQUE À POINTS

Fig. 3. Illustration d'un graphique à points pour les cellules CD14 et CD80. Les cellules négatives aux deux marqueurs figurent en bas à gauche, les cellules positives au en bas à droite et les cellules positives au en haut à gauche. Les cellules positives aux deux marqueurs figurent en haut à droite. L'intensité de la fluorescence augmente de gauche à droite (axe des X) et de bas en haut (axe des Y).
Histogramme
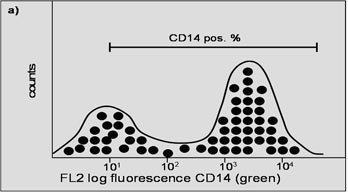
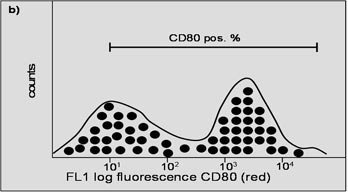
Fig. 4. Ces deux histogrammes représentent les résultats des marqueurs de surface (a) et (b) pris séparément. L'axe des X représente l'intensité de la fluorescence ; l'axe des Y représente le nombre de cellules. La barre représente la quantité de cellules positives.
Conseil : le site anticorps-enligne.fr propose plus de 54,000 antibodies" pour la cytométrie en flux (analyse FACS).
FACS et cytométrie en flux : questions fréquemment posées
Vous trouverez ci-dessous quelques questions et réponses fréquemment posées en rapport avec le FACS et la cytométrie en flux.
Qu'est-ce que la cytométrie en flux et comment fonctionne-t-elle ?
La cytométrie en flux est une technique d'analyse et de tri de cellules ou de particules individuelles sur la base de leurs propriétés physiques et chimiques. Cette méthode consiste à mettre les cellules en suspension dans un flux de liquide et à les faire passer à travers un faisceau laser. La lumière diffusée et émise est ensuite détectée par une série de capteurs et les données qui en résultent sont analysées par un ordinateur. La cytométrie en flux est une méthode qui permet d'analyser rapidement une cellule ou une particule individuelle pendant qu'elle passe à travers un ou plusieurs lasers tout en étant suspendue dans un sel tamponné. Les particules ont été mesurées à la fois en diffusion visible et en fluorescence.
Comment fonctionne la cytométrie en flux ?
La procédure de cytométrie de flux comprend les étapes suivantes :
- Préparation de l'échantillon : l'échantillon est d'abord préparé pour l'analyse. L'échantillon peut être une suspension de cellules ou de particules dans un milieu liquide, par exemple du sang ou un milieu de culture tissulaire.
- Coloration des cellules : pour identifier et différencier différents types de cellules, on colore souvent les cellules avec des colorants fluorescents ou des anticorps qui se lient à certaines molécules à la surface des cellules. De cette manière, les chercheurs peuvent identifier et trier certaines populations de cellules.
- Cellule à flux continu : l'échantillon coloré est ensuite injecté dans une cellule à flux continu, où il est focalisé en un flux étroit qui traverse le faisceau laser.
- Laser : le faisceau laser est utilisé pour exciter les molécules fluorescentes sur les cellules afin qu'elles émettent de la lumière dans des longueurs d'onde spécifiques.
- Détection de la lumière : la lumière émise est détectée par une série de photomultiplicateurs qui mesurent l'intensité de la lumière émise à différentes longueurs d'onde.
- Analyse des données : les données obtenues sont traitées par un ordinateur qui crée un histogramme de l'intensité du signal de fluorescence pour chaque cellule de l'échantillon. Cela permet aux chercheurs d'identifier et de quantifier différentes populations de cellules en fonction de leurs propriétés physiques et chimiques.
- Tri des cellules : si le cytomètre en flux est équipé d'un trieur de cellules, celui-ci permet de séparer physiquement les cellules individuelles en fonction de leurs propriétés de fluorescence. Les cellules triées peuvent ensuite être collectées pour des analyses ou des cultures ultérieures.
Combien de temps dure une analyse par cytométrie de flux ?
La durée d'une analyse par cytométrie de flux peut dépendre de différents facteurs, tels que la complexité de l'échantillon, le nombre de cellules à analyser et l'appareil utilisé. En général, l'analyse d'un seul échantillon peut toutefois durer de quelques minutes à quelques heures. Pour les échantillons plus complexes ou contenant un grand nombre de cellules, l'analyse peut prendre plus de temps. De plus, le tri des cellules peut prendre du temps supplémentaire.
Qu'est-ce que le FACS en cytométrie en flux ?
FACS est l'abréviation de "Fluorescence Activated Cell Sorting" (tri cellulaire activé par fluorescence) et est une technique utilisée en cytométrie en flux pour séparer physiquement les cellules sur la base de leurs propriétés de fluorescence. Dans le FACS, les cellules sont d'abord colorées avec des colorants fluorescents ou des anticorps qui se lient à certaines molécules à la surface des cellules. Les cellules colorées sont ensuite passées dans une cellule à flux continu où elles sont éclairées par un faisceau laser. Pendant que les cellules traversent le laser, leur fluorescence est enregistrée et analysée en temps réel par un ordinateur. Sur la base des propriétés de fluorescence, les cellules sont triées et réparties dans différents tubes de collecte ou plaques. Le FACS est un outil précieux dans de nombreux domaines de recherche, notamment l'immunologie, la recherche sur les cellules souches et la recherche sur le cancer, car il permet d'isoler des populations cellulaires spécifiques en vue d'études ou d'analyses ultérieures.
Quels sont les résultats de la cytométrie en flux ?
Les résultats de l'analyse cytométrique en flux peuvent fournir des informations sur les propriétés physiques et chimiques de chaque cellule ou particule dans un échantillon. Les données générées par l'instrument contiennent des informations sur la taille, la forme, la complexité et l'intensité de la fluorescence de chaque cellule ou particule de l'échantillon. Ces données sont généralement présentées sous la forme d'une série d'histogrammes, de diagrammes de points ou d'autres représentations graphiques qui permettent aux chercheurs de visualiser et d'analyser les caractéristiques des différentes populations de cellules dans l'échantillon. La cytométrie de flux peut également être utilisée pour quantifier le pourcentage de cellules exprimant des marqueurs de surface spécifiques ou des molécules intracellulaires, ce qui permet d'avoir un aperçu de l'état fonctionnel de différentes populations de cellules.
Comment la cytométrie de flux peut-elle aider à analyser la prolifération cellulaire ?
L'analyse de la prolifération cellulaire par cytométrie de flux est une technique fréquemment utilisée pour mesurer la croissance et la division des cellules. Elle est basée sur la mesure de la teneur en ADN des cellules individuelles pendant qu'elles effectuent leur cycle cellulaire. En analysant la teneur en ADN d'une population de cellules, les chercheurs peuvent déterminer le pourcentage de cellules à chaque phase du cycle cellulaire et calculer le taux de multiplication cellulaire. Ces informations sont essentielles dans de nombreux domaines de recherche, tels que la biologie du cancer, la recherche pharmaceutique et la toxicologie, car elles permettent de comprendre les mécanismes sous-jacents à la croissance et à la division cellulaires.
La cytométrie de flux peut-elle détecter l'expression des protéines ?
La cytométrie de flux permet de détecter indirectement l'expression des protéines en utilisant des anticorps marqués par fluorescence qui se lient spécifiquement à la protéine en question. En colorant les cellules avec des anticorps marqués par fluorescence, les chercheurs peuvent mesurer l'abondance et la répartition de la protéine au sein d'une population de cellules. Cette technique, appelée immunofluorescence, est largement utilisée en cytométrie de flux pour analyser l'expression des protéines de la surface cellulaire et des protéines intracellulaires. L'analyse de l'expression des protéines par cytométrie de flux est un outil puissant dans de nombreux domaines de recherche, notamment l'immunologie, la biologie du cancer et la recherche de médicaments.




