En chimie organique, la synthèse peptidique est la production de peptides, dans lesquels plusieurs acides aminés sont liés par des liaisons peptidiques. En revanche, le processus biologique de production de longs peptides (protéines) est généralement appelé biosynthèse des protéines.
L'idée de lier des acides aminés à une chaîne remonte à plus de 100 ans, mais il a fallu environ 50 années supplémentaires pour trouver des solutions aux problèmes qui se posaient. Robert Bruce Merrifield a été le pionnier de la synthèse peptidique en phase solide. Avec la SPPS, il est possible de synthétiser des peptides d'une longueur allant jusqu'à 50 acides aminés. Cette technologie permet de synthétiser des peptides naturels difficiles à exprimer dans les bactéries, d'incorporer des acides aminés non naturels et de générer des peptides uniques afin d'optimiser une réponse biologique souhaitée ou un autre résultat.
L'invention de la synthèse des peptides a conduit au développement de différents domaines d'application dans lesquels les peptides synthétiques sont maintenant utilisés, notamment le développement d'anticorps spécifiques aux épitopes contre les protéines pathogènes, l'étude des fonctions des protéines et l'identification et la caractérisation des protéines. Les peptides synthétiques permettent d'effectuer des recherches sur d'importantes enzymes de signalisation cellulaire telles que les kinases et les protéases, notamment pour comprendre les interactions enzyme-substrat. Enfin, les peptides synthétiques sont utilisés comme étalons et réactifs dans les applications basées sur la spectrométrie de masse (MS). antibodies-online propose une variété de peptides de blocage et de peptides de marquage de haute qualité.
Synthèse de peptides en phase solide SPPS
Pour démarrer la SPPS, l'extrémité C-terminale du premier acide aminé est couplée à un support solide activé, généralement du polystyrol chimiquement non réactif. La résine joue le rôle de groupe protecteur C-terminal, la protéine immobilisée peut être retenue au cours d'un processus de filtration tandis que les réactifs en phase liquide et les sous-produits de la synthèse sont évacués.
Les réactifs en phase liquide et les sous-produits de la synthèse sont évacués.
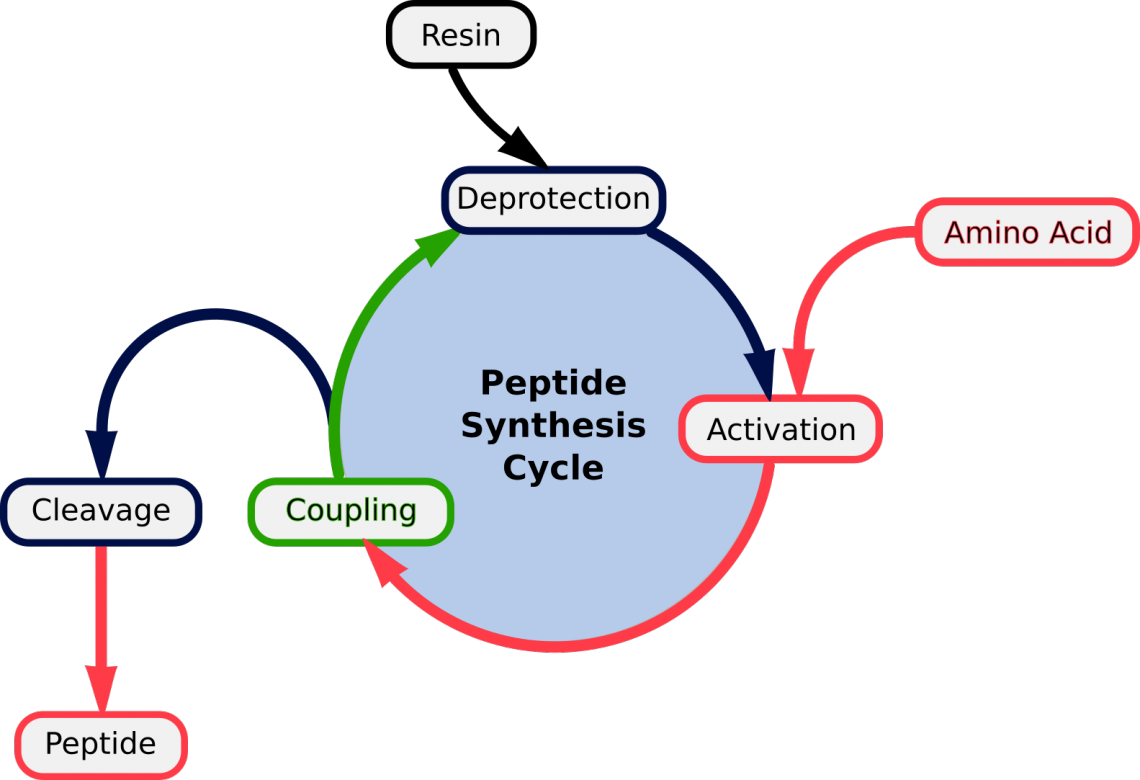
Figure 1. Repeated cycles of (1) Deprotection; (2) Activation of the aa; (3) Coupling | Detachment of mature peptide
Le principe général de la SPPS consiste en des cycles répétés de déprotection-lavage-couplage-lavage (fig.1). The free N-terminal amine of a solid-phase attached peptide is coupled (see below) to a single N-protected amino acid unit. This unit is then deprotected, revealing a new N-terminal amine to which a further amino acid may be attached.
Améliorations et Variantes
Au fil des ans, de nombreuses variantes et améliorations de la SPPS ont été mises au point en échangeant des produits chimiques pour optimiser une certaine application. Différentes résines permettent d'utiliser différents groupes fonctionnels à l'extrémité C-terminale. La résine Wang et la résine oxyméthylphénylacétamidométhyl (PAM) produisent l'acide carboxylique C-terminal conventionnel. En revanche, la résine Rink amide et paraméthylbenzhydrylamine (pMBHA) produit un amide en C-terminal, utile pour imiter l'intérieur d'une protéine. Le Fmoc (Fluorényl-9-méthoxycarbonyle) est un exemple de groupe protecteur N α labile. Les avantages sont une bonne stabilité dans l'acide, une absorption des ultraviolets qui facilite le contrôle et une préparation facile. En outre, les chaînes latérales doivent également être protégées pour éviter la formation de chaînes ramifiées. Il doit être permanent et compatible avec la protection Nα, mais facile à éliminer avec de l'acide une fois la synthèse terminée.
Functional and Protecting Groups
| Functional group | Ser,Thr, Tyr | Asp, Glu | Lys | His | Cys |
| Protecting group | tert-Butylether | tert-Butylester | Boc | Boc / trityl | Trityl |
Figure 2. Functional and protecting groups in peptide synthesis.
L'élimination des groupes protecteurs, en particulier dans des conditions acides, entraîne la production d'espèces cationiques qui peuvent alkyler les groupes fonctionnels de la chaîne peptidique (fig.2). Par conséquent, des piégeurs tels que l'eau, l'anisol ou des dérivés thiol peuvent être ajoutés en excès au cours de l'étape de déprotection pour réagir avec n'importe laquelle de ces espèces réactives libres.
Produits
Références:
- : "Solid-phase peptide synthesis and solid-phase fragment coupling mediated by isonitriles." dans: Proceedings of the National Academy of Sciences of the United States of America, Vol. 110, Issue 29, pp. 11708-13, (2013) (PubMed).
- : "Guide for resin and linker selection in solid-phase peptide synthesis." dans: Current protocols in protein science, Vol. Chapter 18, pp. Unit 18.7, (2008) (PubMed).
- : "p-alkoxybenzyl alcohol resin and p-alkoxybenzyloxycarbonylhydrazide resin for solid phase synthesis of protected peptide fragments." dans: Journal of the American Chemical Society, Vol. 95, Issue 4, pp. 1328-33, (1973) (PubMed).

Creative mind of antibodies-online with a keen eye for details. Proficient in the field of life-science with a passion for plant biotechnology and clinical study design. Responsible for illustrated and written content at antibodies-online as well as supervision of the antibodies-online scholarship program.
Go to author page



